Meilenstein: 1000. AMNOG-Verfahren abgeschlossen
In der deutschen Arzneimittelversorgung ist ein bedeutender Meilenstein erreicht: 1.000 Verfahren im Rahmen des Arzneimittelmarktneuordnungsgesetzes (AMNOG) sind erfolgreich abgeschlossen. Diese tausend AMNOG-Verfahren verteilen sich auf insgesamt 467 Produkte, davon 136 Orphan Drugs. Anlass für fast jedes zweite Verfahren war eine Neueinführung, für mehr als jedes dritte eine Zulassungserweiterung.
Berlin, 9. Juli 2024 (IGES Institut) - Seit der AMNOG-Einführung im Jahr 2011 kam es zudem zu 67 Schiedsverfahren, nachdem im Rahmen der Preisverhandlung keine Einigung zwischen dem jeweiligen pharmazeutischen Hersteller und dem GKV-Spitzenverband erzielt werden konnte. 45 Verfahren befinden sich derzeit im Bearbeitungsprozess (Stand 5. Juli 2024). Das geht aus dem IGES ARA® – AMNOG Resolution Analyzer hervor, der webbasierten AMNOG-Analyseplattform des IGES Geschäftsbereichs IGES Lifescience. Die tatsächliche Anzahl der Verfahren liegt sogar noch höher, da nicht alle Verfahren zu einem erfolgreichen Abschluss gekommen sind.
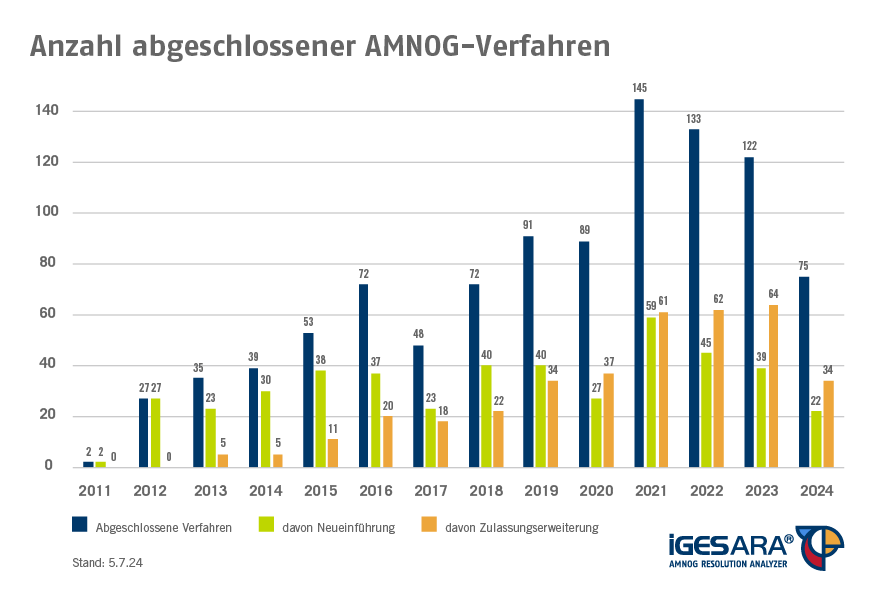
Mehr als 100 AMNOG-Verfahren pro Jahr
Bezogen auf die abgeschlossenen Verfahren zeigt sich im Zeitverlauf, dass es seit 2021 zu deutlich über 100 abgeschlossenen Verfahren pro Jahr gekommen ist. Auch im Jahr 2024 wird diese Grenze aller Voraussicht nach wieder überschritten werden. Bei den Bewertungsanlässen liegt die Neueinführung mit insgesamt 452 Verfahren klar auf Platz eins, gefolgt von Zulassungserweiterungen, welche für 373 Verfahren die Grundlage bildeten.
Einblicke in alle AMNOG-Verfahren
IGES ARA® ist eine webbasierte Plattform, die Recherchen und Analysen zu allen AMNOG-Verfahren ermöglicht und somit umfassende Einsichten in die Nutzenbewertung von Arzneimitteln nach §35a SGB V erlaubt. IGES ARA® bietet Informationen zu allen bisher bewerteten Arzneimitteln auf Ebene der Produkte, Verfahren und Patientenpopulationen bis hin zu Entscheidungen der Schiedsstelle. Auch sind detaillierte Daten zu Erstattungsbeträgen und Preisentwicklungen aller bewerteten Produkte abrufbar.
Details zu betrachteten Endpunkten, Studien und Vergleichstypen geben einen genauen Einblick in das wissenschaftlich-methodische Vorgehen und damit in die Spruchpraxis des Gemeinsamen Bundesausschusses. Dokumente der Europäischen Arzneimittel-Agentur EMA sowie der US-Behörde für Lebensmittel und Arzneimittel FDA ergänzen die Dokumentenbasis.
Das Arzneimittelmarktneuordnungsgesetz (AMNOG) trat am 1. Januar 2011 mit dem Ziel in Kraft die Versorgung der Versicherten mit innovativen und qualitativ hochwertigen Arzneimitteln zu sichern und gleichzeitig für die gesetzlichen Krankenversicherung die Wirtschaftlichkeit der Arzneimittelausgaben zu gewährleisten. Im Rahmen des AMNOG verhandeln pharmazeutische Hersteller und der GKV-Spitzenverband (GKV-SV) Erstattungsbeträge für neue Arzneimittel, basierend auf einer Zusatznutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA).

